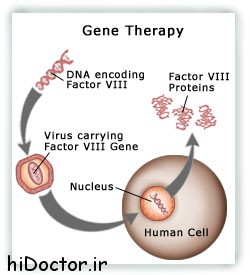
 دستکاری ساختار ژنتیکی و یا ژن. ژن درمانی نامیده می شود. با استفاده از بردار ژن در داخل سلول. از اختلال ژنتیکی برای نسل جدید جلوگیری می شود هدف از ژن درمانی جایگزینی یک ژن سالم به جای ژن معیوب است. پژوهشگران همچنان به بررسی مکانیسم های سالم و موثر برای درمان ژن های دستکاری با هدف درمان و یا درمان اختلالات ژنتیکی است
دستکاری ساختار ژنتیکی و یا ژن. ژن درمانی نامیده می شود. با استفاده از بردار ژن در داخل سلول. از اختلال ژنتیکی برای نسل جدید جلوگیری می شود هدف از ژن درمانی جایگزینی یک ژن سالم به جای ژن معیوب است. پژوهشگران همچنان به بررسی مکانیسم های سالم و موثر برای درمان ژن های دستکاری با هدف درمان و یا درمان اختلالات ژنتیکی است
ژندرماني، روش اصلاح ژنهاي معيوب و عامل بيماري است. اين روش درماني درحال حاضر در مرحله تحقيقاتي است و در اين مرحله شيوههاي مختلفي براي اصلاح ژن مورد مطالعه ميباشد.مهمترين روش به اين منظور قراردادن يک ژن سالم، در ژنوم بيمار است. ژن درماني درحال حاضر در دنيا در مرحله تحقيقاتي ميباشد و هنوز هيچ فرآورده مورد استفاده در ژن درماني توسط اداره غذا و داروي آمريکا تاييد نشده است. تحقيقات باليني انجام شده نيز از موفقيت کمي برخوردار بوده است. اولين ژن درماني در سال 1990 انجام شد که بر روي کودک 4 سالهاي با بيماري نادر ژنتيکي نقص ايمني شديد ترکيبي (SCID) انجام شد. اين بيمار به دليل دارا نبودن سيستم ايمني طبيعي بايد در محيط استريل نگهداري ميشد و مرتب دوز بالاي آنتي بيوتيک مصرف مي کرد در بيمار مزبور گلبولهاي سفيد بيمار گرفته شد و سپس در آزمايشگاه رشد داده شد و ژن سالم به گلبولها وارد و دوباره به بيمار برگردانده شد. مطالعات بعدي نشان داد که سيستم ايمني بيمار تقويت شده است و بيمار مجددا به زندگي عادي برگشت اما اين روش درماني يک درمان مادامالعمر نبود و بيمار مجبور به تکرار درمان در هر چند ماه بودهر چند اين اولين آزمايش به روش ژندرماني بسيار اميدوارکننده به نظر ميرسيد ولي واقعيت امر اين است که به دليل پيچيدگي بيولوژيکي بيش از حد ژندرماني در انسان و نيز عدم شناخت کامل بسياري از بيماريهاي ژنتيکي امکان استفاده وسيع از ژندرماني در انسان ميسر نشده است. بحث ديگر بحث اخلاق پزشکي است و بايد توجه داشت که ژن درماني بر روي سلولهاي سوماتيک (غيرجنسي) و سلولهاي جنسي دو پديده متفاوت است. اگر ژن درماني بر روي سلولهاي جنسي (germs cell) انجام شود، امکان انتقال آن به نسلهاي بعدي نيز وجود دارد درحاليکه در ژن درماني بر روي سلولهاي غيرجنسي (Somatic cell) فقط شخص دريافتکننده ژن بهبود مييابد و ژن مورد نظر به نسلهاي بعدي به ارث نخواهد رسيد. بعضي افراد به هر گونه تغيير ژنتيکي در انسان معترض هستند بدون اينکه مزاياي آن را در نظر بگيرند. بسياري ديگر فقط ژن درماني در سلولهاي غيرجنسي (سوماتيک) را تاييد ميکنند ولي استفاده از ژندرماني در سلولهاي جنسي را نميپذيرند. با اين وجود تعدادي نيز بر اين عقيدهاند که با وضع قوانين جديد ميتوان از ژندرماني در سلولهاي جنسي نيز استفاده کرد. به طور کلي معيارهايي که بايد براي انتخاب بيماري قابل درمان با ژندرماني درنظر گرفت عبارتند از 1) بيماري غيرقابل علاج و کشنده باشد 2) سلولها، بافتها و يا اعضاء بيمار که توسط بيماري تحت تاثير قرار گرفته به خوبي شناسايي شده باشند 3)ژن سالم مورد نظر که قرار است به سلول شخص بيمار وارد شود قبلا جداسازي و کلون شده باشد 4) ژن سالم قادر به ورود به تعداد زيادي سلول بافت مورد نظر باشد 5)ژن به طور مناسبي قابل بيان (express) باشد 6) روشهايي در دسترس باشد که بيخطر بودن آنها به اثبات رسيده باشد.بحثهاي زيادي در تاييد و يا رد ژندرماني وجود دارد. مهمترين موردي که در تاييد ژندرماني مطرح است. امکان درمان بيماري غيرقابل علاج به روش ژندرماني است و موارد زير از ديگر موارد در تاييد ژندرماني هستند 1) ژن درماني باعث درمان کامل بيماري ميشود و فقط علائم را برطرف نمينمايد 2) ژن درماني در سلولهاي جنسي ممکن است تنها وسيله براي درمان بعضي از بيماريهاي ژنتيکي باشد 3) با جلوگيري از انتقال ژن معيوب به نسلهاي بعدي، درمان نسلهاي بعدي لازم نخواهد بود چرا که بيماري به آنها از والدين درمان شده با ژندرماني به ارث نرسيده است.مواردي که در رد ژن درماني مطرح ميشوند بيشتر مبتني بر اين سوىال است که آيا ميتوان بيناستفاده درست و نادرست از روشهاي اصلاح ژنتيکي تمايز قائل شد و آيا امکان سوءاستفاده بالقوه از اين تکنولوژي بايد محققين را از تحقيق بيشتر بر روي اين روش باز دارد. بعضي افراد نيز بر اين نکته تاکيد دارند که پيگيري بيمار در تحقيقات باليني بلند مدت بسيار مشکل است. بيمار تحت درمان با ژندرماني بايد براي دهها سال تحت نظر باشد تا بتوان از اثرات ژندرماني در نسلهاي بعدي مطلع شد. بعضي نيز بر اين عقيدهاند که اطفال به علت سن پايين قادر به تصميمگيري درباره ژندرماني نيستند و مزايا ومعايب آن را به درستي درک نميکنند. به طور خلاصه مواردي که در رد ژندرماني در سلولهاي جنسي مطرح هست شامل 1) فقدان اطلاعات علمي کافي و خطرات باليني زياد آن و نيز ناشناخته بودن اثرات طولاني مدت اين نوع درمان 2) چنين آزمايشاتي ممکن است در نهايت منجر به تشويق ساير محققين به کار بر روي تغيير ژنتيکي در افرادي که بيمار نميباشند شود 3) به دليل آنکه ژندرماني در سلولهاي جنسي مستلزم استفاده از جنين است و در نتيجه بر روي نوزاد متولد شده تاثيرگذار است لذا اين چنين تحقيقي منجر به توليد پروژههاي تحقيقاتي خواهد شد که شخص (جنين پس از تولد) بدون موافقت قبلي مورد آزمايش قرار گرفته است 4) هزينه بالاي ژندرمانيبه طور خلاصه ميتوان درآينده شاهد درمان تعدادي از بيماريهاي ژنتيکي و يا سرطانها به روش ژن درماني بود که قطعا انقلابي در علم پزشکي خواهد بود و راه را براي درمان بسياري از بيماريها باز خواهد کرد.وي درباره شيوه عملکرد در ژندرماني ميگويد: ژن درماني روشي است براي اصلاح ژنهاي معيوبي که باعث ايجاد بيماري ميشوند. روشهاي مختلفي براي اصلاح ژن معيوب وجود دارد که مهمترين آن قراردادن يک ژن سالم در ژنوم بيمار است.در بيشتر مطالعات ژن درماني، يک ژن سالم به جاي معيوب قرار داده ميشود تا ژن مولد بيماري اصلاح شود و يک مولکول حامل ژن که وکتور ناميده ميشود براي انتقال ژن به سلول بيمار استفاده ميشود. يکي از مهمترين وکتورهاي مورد استفاده ويروسهاي دستکاري ژنتيکي شده ميباشند که قادر به حمل DNAانساني هستند. ويروسها توانايي انتقال ژنهاي خود به سلولهاي انساني و در نتيجه ايجاد بيماري را دارند که محققين از همين خاصيت استفاده کرده و ژنهاي مورد نظر به سلولهاي انساني را به کمک ويروسها منتقل ميکنند. معمولا سلولهاي هدف در شخص بيمار توسط ويروسهاي حامل ژن مورد نظر آلوده ميشوند که در نتيجه ژن سالم توسط ويروس در سلول انساني قرار داده ميشود که اين امر باعث توليد پروتئيني ميشود که قبلا شخص بيمار قادر به توليد آن نبوده است و در نتيجه بيماري شخص درمان ميشود علاوه بر ويروسها از ساير وکتورهاي غير ويروسي نيز استفاده ميشود. ليپوزومها يکي ديگر از روشهاي انتقال ژن به داخل سلولها هستند. ليپوزومها کرههايي هستند که در مرکز آنها ژن مورد نظر و در اطراف آن لايه چربي قرار دارد که در نتيجه قادر به عبور از غشاء سلولي و در نتيجه آزادکردن ژن در داخل سلول ميباشند. روش ديگر استفاده از کمپلکسهاي پليکاتيوني است که قادر به اتصال به ژن ميباشد. مخلوط پليمر و ژن قادر به فاگوسيته شدن توسط سلول ميباشند که در نتيجه ژن به داخل سلول وارد و سپس بيان ميشود. تحقيق بر روي دو روش آخر اخيرا مورد توجه بيشتري قرار گرفته است که عمدهترين دلايل آن معايب استفاده از ويروسها به عنوان وکتور است که شامل 1) امکان بروز بيماري ثانويه ناشي از وکتور ويروسي و يا قرار گرفتن ژن در محلي غير از سلولهاي مورد نظر و 2) تغيير ايجاد شده در بيمار معمولا دائمي است بدين معني که بيان ژن در شخص به صورت دائم خواهد بود و در صورت غير مطلوب بودن درمان، امکان بازگشت به حالت اوليه وجود نخواهد داشت. يکي از ديگر دلايل مهم که تحقيق بررسي استفاده از وکتورهاي ليپوزومي و پليکاتيوني را باعث شده است بحث اقتصادي فرآورده نهايي است.در دو روش فوق، ژن درماني موقت است و بيمار مجبور به درمان در فواصل زماني ميباشد که در نتيجه براي شرکتهاي دارويي از جذابيت اقتصادي بيشتري برخوردار است. کاري که ما در اين زمينه انجام داديم اين است که وکتورهاي پليکاتيوني را به کمپلکسهايي متصل کنيم، سپس DNA را با آنها مجاور کنيم، با توجه به اين که DNA بار منفي دارد به پلي کاتيوني که بار مثبت دارد متصل ميشود. سپس آن را در کنار سلولهاي انساني ياحيواني در محيط آزمايشگاه قرار مي دهيم، که اصطلاحا عمل اتصال ژن به پليمر را فاگوسيته کردن ميگويند.يعني اين سلول دو جفتي که کنار آن قرار گرفته لايهاي تشکيل ميدهد، سلول اين کمپلکس را که بين ژن و پليمر کاتيوني تشکيل شده به داخل خود منتقل ميکند درحالي که ژن معمولي توانايي اين انتقال را ندارد داخل سلول نيز با تجزيه شدن توسط آنزيمها از کمپلکس مراقبت ميشود. بنابراين کمپلکس فرصت پيدا ميکند، در سلول به قسمت هسته محلي که ژن در آن مستقر است برسد و بيان شود بيان عبارت است از اکسپرس شدن يعني در زمينه کاري که بايد انجام دهد، شروع به فعاليت کند. مادر اين زمينه پليمري ساختيم از ترکيب پلياتيلن ايميل و دگسترانت اين پليمر توانسته است بيش از 35 درصد سلولهاي حيواني به ژن مربوطه را بيان کند، درحالي که در روشهاي قبل از اين اقدام معمولا 10 درصد سلولها بيان ميشد. مراحل مقدماتي اين پژوهش انجام شده است و اقدامات تکميلي آن در کشور در قالب طرحهاي پژوهشي انجام خواهد شد. در نهايت ميخواهيم ترکيبي بسازيم که بتوانيم به وسيله آن ژن مورد نظر را به بيمار منتقل کنيم که اين فرآورده بتواند ژن را با پليمر ساخته شده مخلوط و يک فرآورده دارويي تهيه کند که ژن مورد نظر به سلولهاي بافت بيمار وارد و بيماري برطرف شود.